1. 서 론
2. 재료 및 방법
2.1 선박평형수를 모사한 인공 해수 제조
2.2 살균 실험
2.3 화학분석
3. 결과 및 고찰
3.1 살균 반응 속도 해석
3.2 이산화염소 농도 영향
3.3 pH 영향과 염소와 살균력 비교
3.4 소독제의 장기 영향 및 THM 생성 비교
4. 결 론
1. 서 론
선박평형수 (Ballast water)란 선박에 화물을 적하 시 부력에 의해 무게 중심이 높아져 선박안정성이 낮아지는 것을 방지하기 위해 선박의 밑 부분에 채우는 물로써, 해로를 통한 선박이동이 대부분이므로 주로 해수가 사용되며 국제적인 무역량이 증가함에 따라 선박평형수의 사용량도 증가하는 추세이다. 국제해사기구 (International Maritime Organization, IMO)에서는 선박 평형수로 세계에서 매년 30 - 50 억 톤 이상의 바닷물이 이동하고 있으며, 7000종 이상의 수중 생물이 선박 평형수와 함께 이동하고 있다고 보고하였다 (Latarche 2014). 선박평형수로 이동된 생물이 새로운 환경에서 정착하여 생존할 확률은 낮으나, 정착에 성공했을 경우 토착생물의 생존을 위협하며 생태계 교란을 일으킬 수 있다. 이에 따라 IMO는 2004년에 ‘선박평형수 처리기준’을 제시하여, 우리나라를 비롯하여 세계의 모든 선박은 2017년부터 선박평형수 처리장치를 의무적으로 장착하고 있다.
한편, IMO의 규정이 명문화되기 이전부터 선박평형수 이동양이 많은 캘리포니아와 뉴욕 등은 선박평형수를 규제 관리해왔으며, 현재는 IMO 규정보다 최대 1000배 강화된 규정을 적용 중이다. 특히 캘리포니아 주의 경우 세계 최고 수준의 선박평형수 처리 기준을 지향하여, 장기적으로 선박평형수 내 미생물 불검출을 목표로 하고 있다. 또한 뉴욕 주의 경우는 2013년 8월부터 모든 선박이 규제대상이되고, 2012년에는 미국해안경비대 (USCG)에서 선박평형수 배출 기준을 제시하였으며, 2013년 12월 1일 이후 제조되는 모든 선박은 이를 만족해야한다 (Table 1). 이처럼 선박평형수 처리에 관해 여러 기준들이 생겨남에 따라 세계적 관심이 높아지고 있으며, 국제 기준을 제시하는 IMO는 앞으로 보다 강력한 규제를 할 것으로 예상된다. 현재 상용화된 선박평형수 처리 기술은 대부분 약품 주입 또는 전기분해로 생성된 염소 (Cl2)를 이용한 살균에 바탕을 두고 있다. 그러나, 염소를 이용한 처리 기술은 pH가 높을 경우 효율이 급격히 저하되며, Trihalomethanes (THM)등과 같은 해양 생태계에 유해한 부산물이 생성될 가능성이 높다는 한계가 있다 (Maranda et al. 2013, Simon et al. 2014). 본 연구에서는 강력한 산화제로 알려져 있는 이산화염소 (ClO2)의 해수 내 미생물 사멸 능력을 염소와 비교 평가하여 선박평형수 처리에 대한 적용 가능성을 타진하였다. 선박평형수를 모사한 다양한 미생물 농도, 소독제 주입량, pH 조건에서 이산화염소의 소독 효과를 조사하고, 살균 반응 속도 및 소독 부산물 생성 여부를 선박평형수 처리에 일반적으로 사용되는 소독제인 염소와 비교 평가하였다.
Table 1. Criteria for ballast water discharge (IMO 2004)
2. 재료 및 방법
2.1 선박평형수를 모사한 인공 해수 제조
대표성이 있는 해수 제조를 위해 ASTM (2013)에서 제안한 해수 조성에 따라 인공 해수를 제조하였으며 (Table 2), 이때 pH는 8.2로 측정되었다. 사용한 시약은 모두 덕산약품 (대한민국)에서 구입하였고 미량물질의 영향을 최소화하기 위하여 희석수로는 초순수를 사용하였다. E. coli, Enterococcus, 종속영양세균의 농도는 G시 소재 하수처리장 유입수를 투입하여 조절하였으며, 이때의 종속영양 세균 (heterotrophic bacteria) 농도는 IMO가 제시하는 mL당 104 colony forming unit (CFU)이상 조건을 만족하였다 (Latarche 2014). 추가로 식물성 플랑크톤 (phytoplankton)의 대표적인 종인 Tetraselmis suecica를 식종하였다 (Creswell 2010). 각 미생물의 초기 농도는 해수에 대한 기존 문헌을 참고하여 설정하였다 (Maranda et al. 2013).
Table 2. Characteristics of artificial seawater (ASTM 2013)
2.2 살균 실험
세균 초기 농도 (E. coli 572 - 8,704 CFU/100 mL, Enterococcus 122 - 1,951 CFU/100 mL), 이산화염소 농도 (0 - 10 mg/L), pH (7.2 - 9.2)를 변화하면서 8 - 12 hr 동안 살균 실험을 수행하였다. Tetraselmis suecica 초기 농도, 온도, 용존 유기탄소 농도는 각각 6,000 cell/mL, 20°C, 5 mg/L으로 고정하였다. pH 영향 고찰 시 동일한 유효 염소량의 염소 (Cl2)를 투입하여 미생물 사멸 효율을 비교 평가하였다. 또한 도출된 최적 조건에서 이산화염소 및 염소 투입 후 42일간 실험을 수행하여 미생물 재성장 여부 및 소독부산물 생성을 검증하였다.
2.3 화학분석
이산화염소 및 염소 농도는 Standard Methods (APHA 1998)의 DPD ferrous titrimetric method (4500-Cl-F)로 측정하였다. E. coli, Enterococcus, heterotrophic bacteria 농도는 IDEXX laboratories Inc. (Maine, USA)의 Colilert18, Enterolert, HPC kit를 이용하여 분석하였다. Tetraselmis suecica의 배양 및 계수는 Standard methods (APHA, 1998) 및 Creswell (2010)을 참고하였다. THMs 항목은 Gas chromatography/mass spectrometry (GC/MS, Bruker 320MS, USA)를 활용하여 측정하였다 (Lee and Lee 2015). 타 분석 항목은 Standard Methods (APHA, 1998)을 준용하여 분석하였다.
3. 결과 및 고찰
3.1 살균 반응 속도 해석
미생물 살균 반응의 동력학적 해석을 위해 세균의 초기 농도를 달리하여 온도 20°C, pH 8.2, 이산화염소 5 mg/L에서 이산화염소를 이용한 살균 실험을 수행하였다. 세균 초기 농도는 하수처리장 유입수의 투입량을 통해 조절하였다. 시간에 따른 세균 및 플랑크톤의 농도 변화는 1차식 Eq. 1 또는 2차식 Eq. 2로 해석하였다.
(Eq. 1)
(Eq. 2)
여기서 C0는 미생물 초기 농도 (CFU/100 mL for bacteria, cells/mL for phytoplankton), C는 시간에 따른 미생물 농도 (CFU/100 mL for bacteria, cells/mL for phytoplankton), k는 살균 반응속도상수 (1차 반응의 경우 hr-1, 2차 반응의 경우 100 mL CFU-1 hr-1 for bacteria, mL cells-1 hr-1 for phytoplankton), t는 살균시간 (hr)이다. E. coli는 초기 개체수 572, 885, 1,847, 4,674, 8,704 CFU/100 mL 조건에서, Enterococcus는 초기 개체수 122, 197, 450, 1,095, 1,951 CFU/100 mL 조건에서 실험을 진행하였으며, 결과를 Table 3에 도시하였다. E. coli 및 Enterococcus 반응 해석 최적화를 위한 모델링 결과 2차 반응의 반응상수 (k) 및 결정계수 (R2)가 1차 반응의 반응상수 및 결정계수에 비해 반응 해석에 적합한 것으로 판단되어 차후 실험 결과 해석은 Eq. 2를 이용하여 세균 농도에 대한 2차 반응으로 해석하였다. 한편 E. coli, Enterococcus 모두 초기 개체수가 많을수록 2차 살균반응속도 k가 감소하는 형태를 보여 미생물 농도에 있어 완전한 2차 반응이 아닌 유사 2차식인 것으로 나타났다. 이는 이산화염소에 의한 세균의 소독 반응이 단순한 1차 또는 2차 반응이 아닌 여러 단계로 구성된 다소 복잡한 기작에 의해 진행되기 때문인 것으로 사료된다 (Benarde et al. 1967). 반면 Tetraselmis suecica의 경우 1차 반응의 반응상수 (k) 및 결정계수 (R2)가 2차 반응의 반응상수 및 결정계수에 비해 반응 해석에 적합한 것으로 판단되어 차후 실험 결과 해석은 1차 반응으로 해석하였다 (Table 4).
Table 3. Disinfection of E. coli and Enterococcus by chlorine dioxide at various initial bacterial contents
Table 4. Disinfection of Tetraselmis suecica by chlorine dioxide
3.2 이산화염소 농도 영향
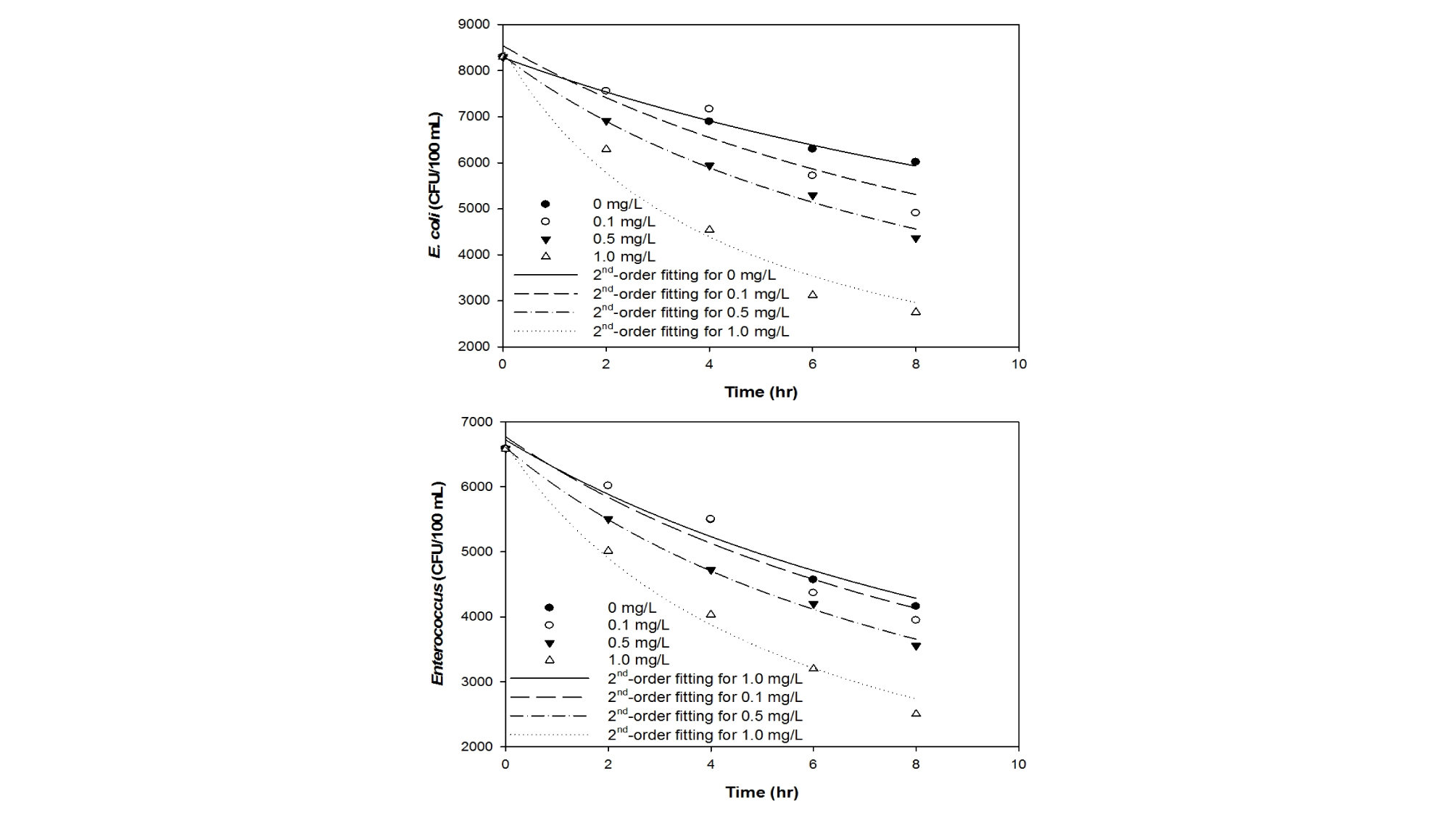
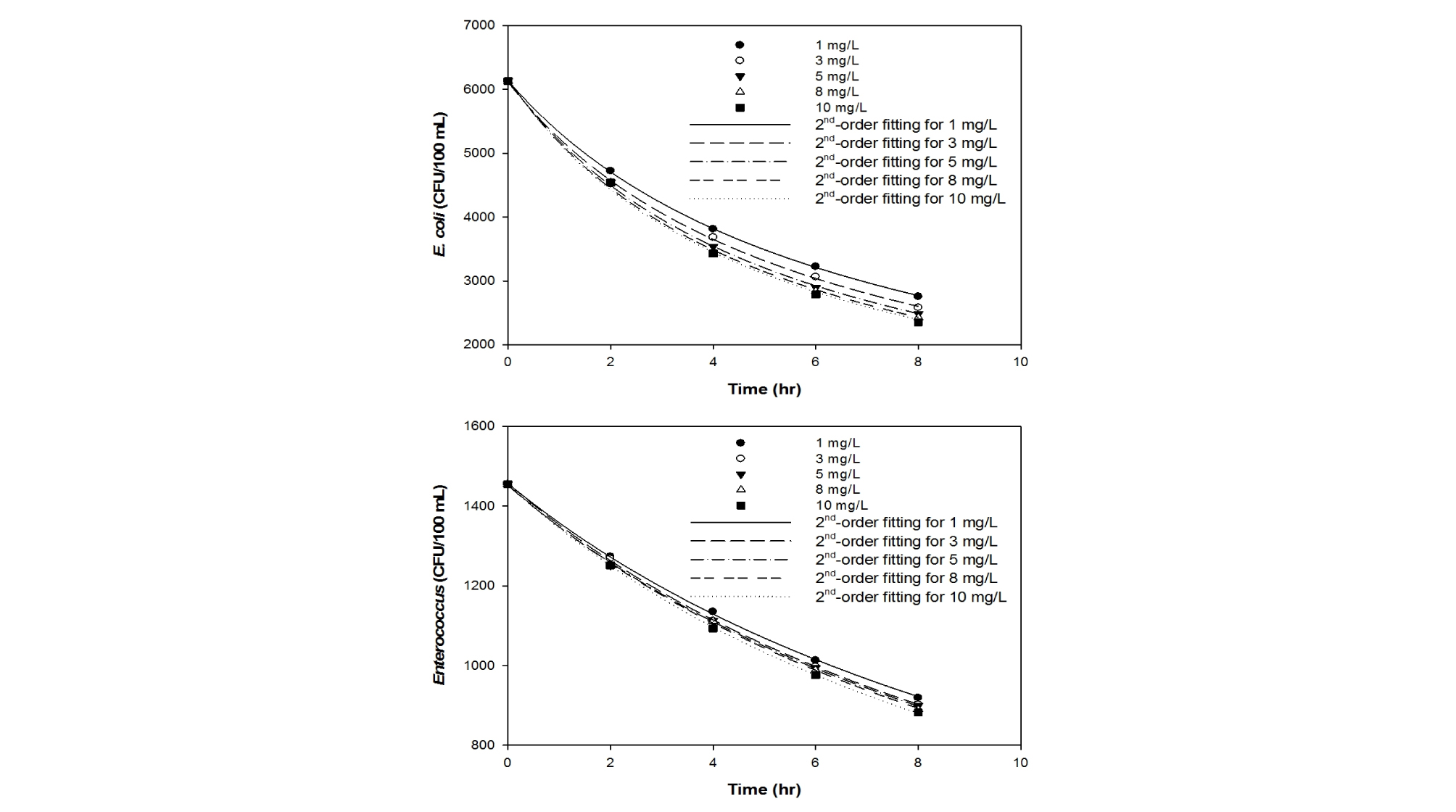
이산화염소 투입 농도를 0, 0.1, 0.5, 1 mg/L로 변화시키면서 8시간 동안 살균 실험을 수행한 결과, 대조군에 비해 이산화염소 투입 시 미생물의 농도가 확연히 줄어들고, 이산화염소 농도의 증가에 따라 살균 반응 속도가 향상됨을 효율이 향상됨을 확인하였다 (Fig. 1). 이에 추가적으로 이산화염소의 농도를 1, 3, 5, 8, 10 mg/L로 달리하여 8시간 동안 살균 실험을 진행하였으며, 1 mg/L 이상에서는 이산화염소 농도 증가에 따른 살균 증대 효과가 미미한 것을 확인하였다 (Fig. 2). 이산화염소 제조에 소요되는 비용을 절감하고 해수 방류 시 이산화염소에 의한 생태계 2차 교란을 방지하기 위하여, 추후 살균 조건 도출 실험은 최적 이산화염소 농도인 1 mg/L에서 진행하였다.
3.3 pH 영향과 염소와 살균력 비교
해수의 pH 농도 및 소독제 종류에 따른 E. coli 및 Enterococcus의 살균 반응속도를 비교하는 실험을 수행하였다. 염소와의 살균 영향을 대조하기 위해 환원 반응식 (Eqs. 3 and 4)을 참조하여 유효염소농도를 동일하게 하였으며 (이산화염소 1 mg/L, 염소 2.63 mg/L), pH에 따른 세균 농도 및 살균 반응 해석 결과를 각각 Tables 5 and 6에 나타내었다.
ClO2 + 5e- + 4H+ → Cl- + 2H2O (Eq. 3)
0.5Cl2 + e- → Cl- (Eq. 4)
pH 7.2에서의 살균력은 이산화염소와 염소가 유사하였지만, pH 8.2와 9.2에서는 이산화염소가 염소에 비해 우수한 살균 효과가 있음을 확인하였다. 해수의 pH가 통상적으로 8.0 이상임을 감안할 때, 동일한 유효염소 농도에서 이산화염소가 염소에 비해 우수한 세균 살균력을 보일 것으로 판단된다. 이는 염소의 경우 차아염소산 이온 (OCl-)에 비해 살균력이 100배 정도 높은 차아염소산 (HOCl)의 비율이 pH가 증가할수록 감소하나 (MetCalf and Eddy 2014), 이산화염소의 경우 pH에 따른 이온화가 진행되지 않기 때문인 것으로 판단된다.
HOCl → H+ + OCl- (pKa: 7.58 at 20°C) (Eq. 5)
3.4 소독제의 장기 영향 및 THM 생성 비교
평형수 처리 소독제 투입 시기를 결정하기 위해, 이산화염소 주입 시 E. coli, Enterococcus, Total coliforms, Tetraselmis suecica 대한 영향을 42일 동안 관찰하였다 (Table 5). 실험 결과, 42일 이후 E. coli의 농도는 각각 855 CFU/100 mL에서 82 CFU/100 mL로 감소하였고, Enterococcus의 농도는 637 CFU/100 mL에서 75 CFU/100 mL로 감소하여 IMO기준에 따른 개발목표치인 <200 및 <80 CFU/100 mL를 달성함을 보여주었다. 그러나, 시간에 따른 E. coli 및 Enterococcus 농도 변화를 살펴보면 30일 이후 조금씩 농도가 증가함을 볼 수 있다. 소독제 처리 후 장기 보관 시 세균의 재증식은 Maranda et al. (2013) 등 기존 문헌에서도 보고된 바 있는 현상이며, 평형수의 경우 30일 이상의 보관은 적절치 않은 것으로 판단된다. 한편, Tetraselmis suecica은 4일 이후 전혀 발견되지 않았다.
Table 5. Effect of pH on the disinfection of E. coli and Enterococcus by chlorine dioxide
한편, 42일 이후 이산화염소 처리군, 염소 처리군, 대조군에서의 THM (trichloromethane, dichlorobromomethane, dibromochloromethane, tribromomethane)을 분석한 결과를 Table 6에 나타내었다. 이산화염소 실험군의 경우, dichlorobromomethane 만 1.58 µg/L 검출되었으나, 이는 대조군에서도 1.57 µg/L으로 검출된 물질이었다. 1 mg/L의 이산화염소를 이용한 평형수 처리는 THM 생성을 유발하지 않을 것으로 사료된다. 반면, 동일한 유효 농도의 염소를 사용한 경우 trichloromethane 4.55 µg/L, dichlorobromomethane 1.82 µg/L가 검출되어, 이산화염소를 이용한 선박평형수 살균이 상대적으로 해양 생태계에 미치는 잠재적인 부작용이 낮은 방안이라는 것을 확인하였다.
Table 6. Effect of pH on the disinfection of E. coli and Enterococcus by chlorine
Table 7. Time-dependent in concentrations of E. coli, Enterococcus, Tetraselmis suecica, and heterotrophic bacteria with chlorine dioxide at 1 mg/L
Table 8. Trihalomethane, dichlorobromo methane, dibromochloro methane, tribromomethane concentrations after 42 days treatment of Cl2 and ClO2
| Chemicals | Trichloro methane (µg/L) | Dichlorobromo methane (µg/L) | Dibromochloro methane (µg/L) | Tribromomethane (µg/L) |
| Control | N.D | 1.57 | N.D | N.D |
| Cl2 | 4.55 | 1.82 | N.D | N.D |
| ClO2 | N.D | 1.58 | N.D | N.D |