1. 서 론
2. 연구 방법
2.1 조사지 개황
2.2 자료 처리 및 분석
3. 결과 및 고찰
3.1 생태우수습지의 외래식물 현황
3.2 습지유형별 외래식물 현황
3.3 습지유형별 외래식물 군집 특성
4. 결론 및 제언
1. 서 론
습지는 생물의 생장기를 포함한 상당 기간 수위가 유지됨으로써 독특한 토양 및 유기물 환경을 가지며, 수분이 포화된 토양에 적응하고 내성을 가진 식물이 생육하는 등 다른 생태계와 뚜렷이 구분되는 특징을 가진다 (Mitsch and Gosselink 2000). 하지만 습지를 지칭하는 정의와 용어는 무수히 많으며 종종 모순된 의미가 전달되기도 한다. 현재 가장 널리 통용되는 습지의 과학적인 정의는 육상 생태계와 수생태계 사이의 전이지역으로 지하수면이 지표면에 근접해있거나 지면이 얕은 물로 덮여 있는 곳을 말한다 (Cowardin et al. 1979). 이러한 습지를 정의하기 위해서는 기본적으로 3가지 지표인 수문, 토양, 식생이 바탕이 되며, 이 요인들은 서로 유기적으로 상호작용하며 습지에 서식하는 생물로부터 다양한 피드백을 받는다 (Carter 1996, Mitsch and Gosselink 2000).
습지는 다양한 사회‧생태학적 기능 및 역할을 수행하고 있음에도 불구하고 개발 및 이용의 대상으로 인식되어 육역화 및 부영양화, 수문학적 교란, 서식처 파괴, 생물다양성 감소 등 지속적인 교란 및 소실의 위협을 받고 있다 (Mitsch and Gosselink 2000, Brinson and Malvárez 2002, Zedler and Kercher 2004, Davidson 2014). 이러한 위협에 의해 자연적인 장애물이 사라지게 되면 자생종에 비해 경쟁 우위를 쉽게 점할 수 있는 외래종의 유입 및 확산 기회가 만들어지게 된다 (Valéry et al. 2008).
습지는 주변 교란에 의해 발생하는 퇴적물, 유기물, 중금속 그리고 기타오염 물질 등을 축적하는 흡수원으로서 작용하기 때문에 생물학적 침입에 취약하다 (Leopold et al. 1995, Ervin et al. 2006, Reshi et al. 2008, Mayoral et al. 2018). 또한 주변에 도로와 같은 선형 구조의 밀도가 높거나 지대가 낮을수록 외래식물의 종풍부도가 증가하며, 이러한 경관의 위치가 분산 경로 및 교란 요인과 상호작용하여 식물의 정착을 촉진시킨다 (Parendes and Jones 2000, Zedler and Kercher 2004). 대부분의 습지는 하천 네트워크를 따라 발생함으로써 지대가 낮은 곳에 위치하며, 사회‧경제적 주요 활동영역과도 중복된다. 이로 인해 지표수의 흐름을 따라 각종 물질의 유입뿐만 아니라 홍수 파동과 같은 물리적인 교란도 받게 된다 (Stohlgren et al. 1998, Tickner et al. 2001). 따라서 저지대에 위치한 하천 및 호수형 습지에서는 외래식물의 침입이 용이할 것이며 (Hood and Naiman 2000), 지대가 높고 접근성이 낮은 산지형 습지는 상대적으로 외래식물의 유입이 적을 것으로 예측된다.
현재 국립생태원 습지센터는 전국을 대상으로 습지 발굴 및 이력관리를 위한 모니터링 조사를 수행하고 있으며, 발굴된 습지의 등급 평가 (Ⅰ- Ⅳ등급 부여)를 통해 국가습지정보를 구축하고 있다. 습지등급이 Ⅰ, Ⅱ 등급으로 평가된 습지를 중심으로 정밀조사 사업을 수행하고 있으며, 조사 결과를 바탕으로 습지보호지역을 지정하기 위한 절차를 거치게 된다. Ⅰ, Ⅱ 등급 습지는 멸종위기야생생물의 주요 서식지이면서 식생 및 지형‧지질학적 요소가 뛰어나 보전가치가 높은 장소로, 이를 생태우수습지라고 일컫는다 (MOE 2010).
습지 생태계의 건강성을 저하시키는 교란에 대한 다양한 연구가 국외에서 진행되고 있으며, 최근에는 외래생물의 침입으로 저하되는 습지 내 생물다양성과 주변 생태계로 확산하여 나타나는 위협요인 및 관리방안에 대한 연구가 주를 이루고 있다 (Middleton 1999, Chipps et al. 2006, Ehrenfeld 2008, Catford et al. 2011, Canavan et al. 2018). 그러나 우리나라에서는 습지의 기능, 유형 및 특성에 따른 외래식물의 종다양성과 분포 등에 관한 연구는 미흡한 실정이다. 따라서 본 연구에서는 내륙습지 유형에 따라 분포하는 외래식물의 출현현황 및 특성을 파악하기 위하여 (1) 전국내륙습지 정밀조사가 수행된 생태우수습지의 유형을 분류하고 식물상 자료를 정리 및 분석하여, (2) 습지에서 출현하는 외래식물의 현황 및 특성 그리고 습지 유형에 따라 나타나는 차이점을 파악하였다. 이를 통해 (3) 습지 보전 및 관리 계획 수립 시 기초자료를 제공하고자 한다.
2. 연구 방법
2.1 조사지 개황
생태우수습지를 대상으로 외래식물 분포 현황 및 특성을 파악하기 위하여, 2012년부터 2019년까지 수행된 전국내륙습지 정밀조사의 식물상 자료를 이용하였다 (MOE 2012, 2013, 2014, 2015, 2016, 2017, 2018, 2019). 8년간 조사된 생태우수습지는 총 24개이며 유형별로는 호수형; 우습제 (UJ), 백석제습지 (BS), 백련제습지 (BR), 백곡지습지 (BG), 동림저수지 (DR), 질날늪 (JN), 옥정호 (OJ) 7개, 하천형; 비내섬 (BN), 침실습지 (CS), 대봉습지 (DB), 도리섬 (DR), 간월호습지 (GW), 황정습지 (HJ), 현천리습지 (HC), 합강습지 (HG), 장록습지 (JR), 완사늪 (WS), 용양보습지 (YY) 11개, 산지형; 천축산습지 (CC), 물찻오름 (MC), 면산습지 (MS), 릴리리뻔데기습지 (RP) 숨은물뱅듸 (SB), 심적습지 (SJ) 6개이다 (Table 1, Fig. 1). 습지의 유형분류는 국가습지의 유형별‧등급별 분류 및 유형별 습지복원 매뉴얼 작성 연구 (MOE 2010)에서 정립한 국가습지유형분류체계를 따랐다. 내륙습지는 입지와 지형에 따라 호수형 (Lacustrine); 담수호습지, 간척호습지 등, 하천형 (Riverine); 하도습지, 보습지 등, 산지형 (Mountainous Palustrine); 저층습원, 소택지 등으로 구분된다.
Table 1.
Abbreviation, locality, area, type and survey year of the study sites
|
Site (abbreviation)
|
Locality
|
Area (km2)
|
Type
|
Servey year
|
|
Baekgokji wetland (BG)
|
Jincheon-gun
|
0.532
|
Lacustrine
|
2015
|
|
Baekryeonjae wetland (BR)
|
Gokseong-gun
|
0.152
|
Lacustrine
|
2013
|
|
Baekseokje wetland (BS)
|
Gunsan-si
|
0.126
|
Lacustrine
|
2016
|
|
Dongrim reservoir wetland (DG)
|
Gochang-gun
|
2.775
|
Lacustrine
|
2016
|
|
Jilnal wetland (JN)
|
Haman-gun
|
0.169
|
Lacustrine
|
2014
|
|
Okjeongho wetland (OJ)
|
Imsil-gun
|
1.181
|
Lacustrine
|
2018
|
|
Usupje wetland (UJ)
|
Naju-si
|
0.426
|
Lacustrine
|
2013
|
|
Binaesum wetland (BN)
|
Chungju-si
|
1.734
|
Riverine
|
2018
|
|
Chimsil wetland (CS)
|
Gokseong-gun
|
2.160
|
Riverine
|
2015
|
|
Daebong wetland (DB)
|
Changnyeong-gun
|
0.505
|
Riverine
|
2014
|
|
Dorisum wetland (DR)
|
Yeoju-si
|
2.203
|
Riverine
|
2019
|
|
Ganwolho wetland (GW)
|
Seosan-si
|
7.078
|
Riverine
|
2016
|
|
Hapgang wetland (HG)
|
Sejong-si
|
2.009
|
Riverine
|
2014
|
|
Hwangjeong wetland (HJ)
|
Yeongcheon-si
|
2.033
|
Riverine
|
2017
|
|
Hyuncheonri wetland (HC)
|
Hoengseong-gun
|
0.298
|
Riverine
|
2012
|
|
Jangrok wetland (JR)
|
Gwangju-si
|
1.185
|
Riverine
|
2018
|
|
Wansa wetland (WS)
|
Sacheon-si
|
1.694
|
Riverine
|
2015
|
|
Yongyangbo wetland (YY)
|
Cheorwon-gun
|
0.768
|
Riverine
|
2019
|
|
Cheonchuksan wetland (CC)
|
Uljin-gun
|
0.017
|
Mountainous palustrine
|
2014
|
|
Mulcha-oreum wetland (MC)
|
Jeju-si
|
0.004
|
Mountainous palustrine
|
2012
|
|
Myeonsan wetland (MS)
|
Bonghwa-gun
|
0.231
|
Mountainous palustrine
|
2015
|
|
Rilririppeondegi wetland (RP)
|
Suncheon-si
|
0.561
|
Mountainous palustrine
|
2017
|
|
Simjeok wetland (SJ)
|
Inje-gun
|
0.179
|
Mountainous palustrine
|
2013
|
|
Sumeunmulbaendui wetland (SB)
|
Jeju-si
|
1.175
|
Mountainous palustrine
|
2012
|
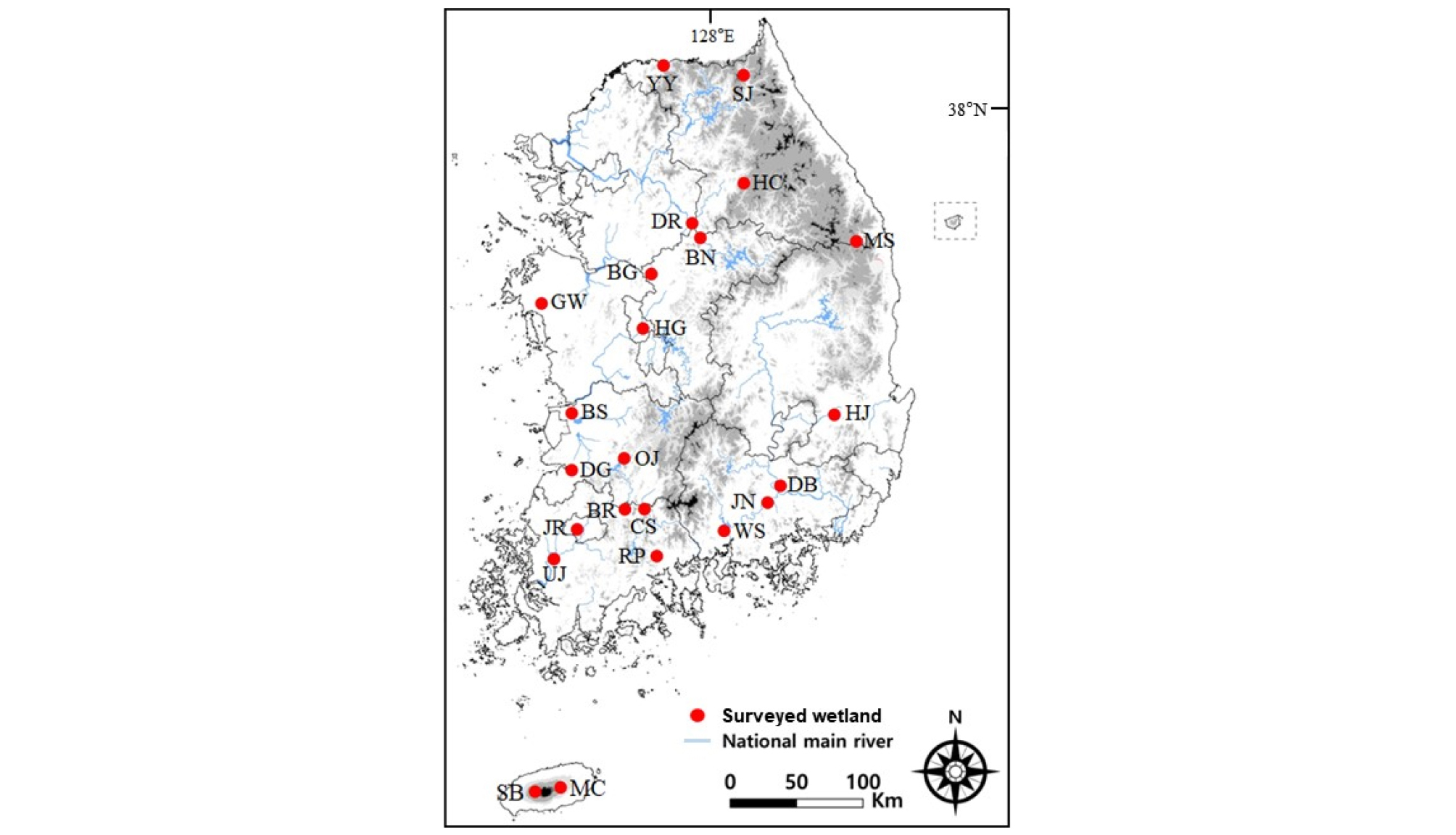
Fig. 1.
Location of surveyed ecologically outstanding wetlands in South Korea (abbreviation in Table 1).
8년간 24개 생태우수습지에서 조사된 식물은 총 149과 532속 1,177종이다. 심적습지에서 가장 많은 315종이 조사되었고, 대봉습지에서 가장 적은 96종이 조사되었다. 조사된 습지 가운데 물찻오름이 0.004 km2로 면적이 가장 작으며 간월호습지가 7.078 km2로 가장 넓다.
2.2 자료 처리 및 분석
생태우수습지에서의 식물상 조사는 전국내륙습지 조사지침 (MOE 2011)을 준용하여 수행하였다. 이 중 외래식물상 자료는 한국외래생물정보시스템 (KIAS 2020)을 참고하여 추출하였으며, 숨은물뱅듸와 물찻오름은 외래식물이 출현하지 않아 분석에서 제외하였다. 추출한 외래식물상 자료를 이용하여 도시화지수 (Urbanization index, UI), 귀화율 (Naturalization index, NI), 일‧이년생 및 다년생 비율을 산출하였다. 도시화지수는 국내에서 현재까지 보고되어 있는 귀화식물의 총 분류군 수 (337분류군)에 대한 대상 습지의 귀화식물 분류군 수로 산정하였다 (Yim and Jeon 1981). 귀화율은 대상 습지 전체 식물 분류군 수 중 귀화식물의 분류군 수의 비율로 산정하였다 (Numata 1978).
모든 통계 분석은 R 환경에서 수행되었다 (R version 3.5.2, R Core Team 2020). 첫째, 습지 유형에 따른 외래식물 출현종수의 차이를 검증하기 위해 ‘aov’ 함수를 이용하여 일원분산분석 (One-way ANOVA)을 수행하였다. 다중비교 (multiple comparision)를 위한 사후검정방법 (post hoc test)으로는 집단의 표본수가 다르기 때문에 샤페검정법 (Scheffe`s method)을 이용하였다. 따라서 Agricolae package의 ‘scheffe.test’ 함수를 이용하여 다중비교를 수행하였다 (de Mendiburu and de Mendiburu 2020).
둘째, 외래식물상 및 습지 유형에 따른 조사지점 사이의 관계를 분석하기 위하여, Vegan package의 'hclust' (method = 'ward.D2') 함수를 사용하여 계층적 군집분석 (hierarchical cluster analysis)을 수행하였다 (Oksanen et al. 2020). 분석에는 지역적 특이성을 배제하기 위하여, 외래식물상 조사에서 2개 습지 이하에서 출현한 외래식물을 제외하였다. 따라서 3개 이상의 조사 지점에서 출현한 외래식물을 활용하였다.
셋째, 습지 유형에 따른 외래식물상 조성에 대한 차이를 파악하기 위해 비계량형다차원척도법 (non-metric multidimensional scaling, NMDS)를 실시하였다. 군집구조의 조사지점 사이 거리는 Bray-Curtis 방식 (Bray and Curtis 1957)으로 산출하여 Vegan package의 ‘metaMDS’ 함수로 수행하였다 (Oksanen et al. 2020).
3. 결과 및 고찰
3.1 생태우수습지의 외래식물 현황
외래식물이 확인되지 않은 물찻오름과 숨은물뱅듸를 제외한 22개 생태우수습지에서 조사된 외래식물은 총 27과 60속 130종으로 나타났다 (Appendix 1). 이 중 국화과가 40종으로 총 종수의 27%를 가장 많이 차지하였으며, 콩과 16종 (11%), 벼과 16종 (11%), 십자화과 7종 (5%) 순으로 많았다. 출현빈도가 가장 높은 외래식물은 21개소에 출현한 개망초 (Erigeron annuus)였으며, 그 다음으로는 달맞이꽃 (Oenothera odorata) 20개소, 아까시나무 (Robinia pseudo-acacia), 망초 (Erigeron Canadensis) 18개소, 미국가막사리 (Bidens frondosa), 미국자리공 (Phytolacca americana), 서양민들레 (Taraxacum officinale), 소리쟁이 (Rumex crispus), 족제비싸리 (Amorpha fruticose), 토끼풀 (Trifolium repens) 15개소 순이었다. 습지별로는 침실습지와 간월호습지에서 가장 많은 50종이 조사되었고, 그 다음으로 백곡지습지 (48종), 동림저수지습지 (47종), 황정습지 (46종) 순으로 나타났다. 생태우수습지 중 2016년도에 습지보호지역으로 지정된 침실습지에서 가장 많은 외래식물이 출현하였는데, 습지의 좌안과 우안의 제방을 따라 차량 통행이 가능한 자전거 도로가 개설되어 외래식물의 유입과 확산이 용이하기 때문으로 보인다 (MOE 2015). 생태계교란생물은 돼지풀, 미국쑥부쟁이, 단풍잎돼지풀, 가시박, 가시상추, 애기수영, 서양금혼초, 도깨비가지, 물참새피, 털물참새피, 양미역취 총 11종이 발견되었으며, 미국쑥부쟁이와 돼지풀은 생태우수습지 22개소 중 50% 이상 (12개소) 습지에서 출현하였다. 특히 지역적으로 분포가 한정적인 것으로 알려진 단풍잎돼지풀, 서양금혼초, 양미역취, 털물참새피, 물참새피의 경우 (NIE 2017), 용양보습지, 동림저수지습지, 백곡지습지, 백석제습지 등에서 분포가 확인되어 확산에 대한 집중적인 모니터링 수행과 잠재적 분포지 예측을 통해 선제적으로 관리하는 것도 중요할 것으로 판단된다 (Lee et al. 2016).
3.2 습지유형별 외래식물 현황
습지유형에 따른 외래식물 종수는 하천형과 호수형 습지에서 평균 30종 내외로 평균 10종 미만인 산지형 습지보다 종풍부도가 높은 것으로 분석되었다 (Table 2). 호수형 습지 중 질날늪에서 10종으로 가장 적었으며 백곡지습지에서 48종으로 가장 많았다. 하천형 습지에서는 대봉습지가 11종으로 가장 적었으며 침실습지에서 50종으로 가장 많이 출현하였다. 산지형 습지 중 물찻오름과 숨은물뱅듸에서는 외래식물이 출현하지 않아, 교란이 거의 발생하지 않는 건강한 생태계를 유지하고 있는 것으로 파악된다.
Table 2.
Number of alien plants (AP), naturalization index (NI), urbanization index (UI), and ratio of life cycle according to the types of wetland
|
Site
|
AP
|
NI
|
UI
|
Life cycle (%)
|
|
Annual&Biennial
|
Perennial
|
| Lacustrine |
|
Baekgokji wetland
|
48
|
19.5
|
14.2
|
58.3
|
41.7
|
|
Baekryeonjae wetland
|
23
|
21.3
|
6.8
|
65.2
|
34.8
|
|
Baekseokje wetland
|
23
|
13.6
|
6.8
|
69.6
|
30.4
|
|
Dongrim reservoir wetland
|
47
|
16.5
|
13.9
|
70.2
|
29.8
|
|
Jilnal wetland
|
10
|
9.4
|
3.0
|
80.0
|
20.0
|
|
Okjeongho wetland
|
26
|
14.5
|
7.7
|
61.5
|
38.5
|
|
Usupje wetland
|
29
|
13.9
|
8.6
|
72.4
|
27.6
|
| Riverine |
|
Binaesum wetland
|
38
|
17.8
|
11.3
|
65.8
|
34.2
|
|
Chimsil wetland
|
50
|
17.4
|
14.8
|
72.0
|
28.0
|
|
Daebong wetland
|
11
|
11.5
|
3.3
|
81.8
|
18.2
|
|
Dorisum wetland
|
34
|
20.6
|
10.1
|
58.2
|
41.2
|
|
Ganwolho wetland
|
50
|
27.6
|
14.8
|
74.0
|
26.0
|
|
Hapgang wetland
|
36
|
20.0
|
10.7
|
66.7
|
33.3
|
|
Hwangjeong wetland
|
46
|
34.3
|
13.6
|
73.9
|
26.1
|
|
Hyuncheonri wetland
|
20
|
7.3
|
5.9
|
55.0
|
45.0
|
|
Jangrok wetland
|
38
|
21.5
|
11.3
|
63.2
|
36.8
|
|
Wansa wetland
|
28
|
13.3
|
8.3
|
60.7
|
39.3
|
|
Yongyangbo wetland
|
24
|
11.4
|
7.1
|
66.7
|
33.3
|
| Mountainous palustrine | | | | | |
|
Cheonchuksan wetland
|
4
|
2.8
|
1.2
|
50.0
|
50.0
|
|
Myeonsan wetland
|
5
|
2.3
|
1.5
|
60.0
|
40.0
|
|
Rilririppeondegi wetland
|
11
|
3.8
|
3.3
|
63.6
|
36.4
|
|
Simjeok wetland
|
11
|
3.5
|
3.3
|
72.7
|
27.3
|
습지유형별 외래식물 종수의 차이를 파악하기 위한 일원분산분석 결과에 따르면, 하천형과 호수형 습지 간에는 유의한 차이가 없었으나 산지형 습지와는 모두 유의한 차이가 있는 것으로 나타났다 (p < 0.05, Fig. 2). 하천과 호수는 외래식물 종의 직접적인 이동통로일 뿐만 아니라 분포 확산을 야기하는 도로와 상당히 밀접하여 외래식물의 유입이 더 수월하며, 특히 하천형 습지의 경우 상류에서 종자 형태로 유입되는 기회도 상당수가 있을 것이다 (Levine 2001). 이로 인해 하천형과 호수형 습지에서 외래종수가 절대적으로 많은 것으로 판단된다.
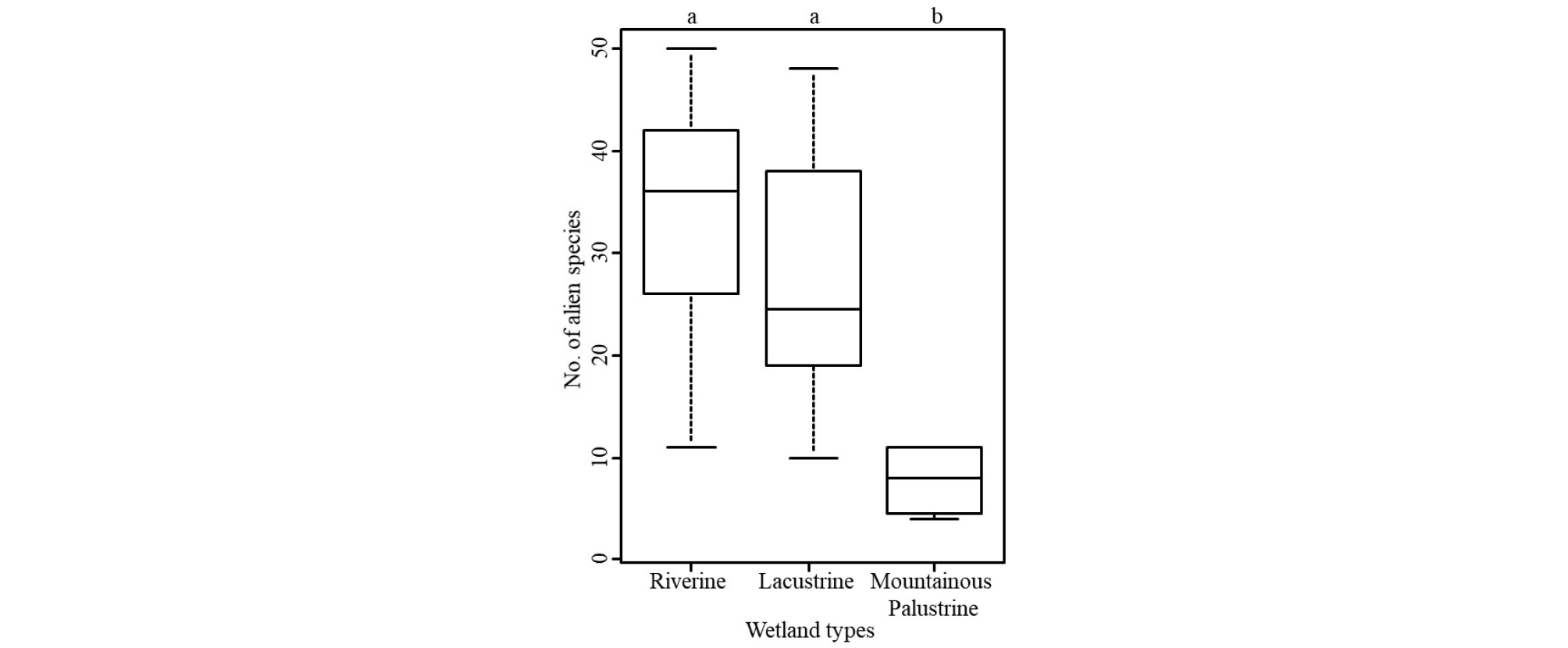
Fig. 2.
Comparison of number of alien species by types of wetland. The horizontal line within the box indicates the median, boundaries of the box indicate the 25th- and 75th- percentiles. Error bars indicate the value of range from the greatest to the least. Different letters above the graph mean significant differences between types of wetland (p < 0.05).
습지 유형에 따른 귀화율과 도시화지수도 외래종수 결과와 유사하게 나타났다 (Table 2). 하천형과 호수형 습지에서 평균 15 - 20% 이내의 귀화율과 평균 8 - 10%의 도시화지수가 산출되었으며 산지형 습지에서는 각각 평균 3% 이내의 값이 산출되었다. 생활사에 따른 외래식물의 비율은 습지유형 구분없이 일이년생 비율이 50 - 70% 사이로 높게 나타났다. 다만 산지형습지에서 다년생 외래식물 비율이 다른 습지유형에 비해 10% 정도 다소 높은 것으로 나타났다. 교란에 의해 경쟁종이 제거됨으로서 발아 기회가 높아지는 외래식물의 특성은 고도, 위치 등 자연적인 장애물이 존재하는 산지형 습지에서 상대적으로 반영되지 못한다 (DeFerrari and Naiman 1994). 따라서 안정적인 생태계가 유지되어 천이 초기종인 일년생 식물이 유입될 기회는 적으며, 다년생 식물 종수의 비율이 다소 높은 것으로 판단된다 (Abella 2010).
3.3 습지유형별 외래식물 군집 특성
생태우수습지의 외래식물상 자료를 사용한 계층적 군집분석에서 출현종의 차이에 따라 4개의 그룹으로 구분되었다 (Fig. 3). Group 1 - 3 집단은 하천과 호수형 습지가 혼재된 반면 Group 4는 산지형 습지로만 구성된 것으로 나타났다. 구분된 4개의 그룹은 그룹별 평균 외래식물 종수에서 유의한 차이가 나타났다 (Group 1, 평균 40종; Group 2, 평균 26종; Group 3, 평균 10종; Group 4, 평균 7종; p < 0.001). Group 2는 Group 1에 비해 산림생태계 또는 인위적 교란의 빈도가 낮은 소규모의 논‧밭, 주거지 등으로 둘러싸여 미국실새삼, 미국쑥부쟁이, 큰금계국, 갓, 도꼬마리 등 Group 1에서 출현 빈도가 높은 종의 출현이 제한적인 것으로 나타났다. Group 3에 속하는 대봉습지와 질날늪의 경우 Group 1, 2에서 흔하게 관찰되는 족제비싸리, 붉은토끼풀, 선개불알풀, 오리새 등이 관찰되지 않는 등 외래종수가 11종 미만으로 출현하여 별도의 그룹으로 분리된 것으로 보인다. 두 습지 모두 왕버들군락이 둘러싸는 형태로써 외래식물의 자연적인 유입은 어려운 것으로 보이나 주변으로 농경지, 제방 등 교란요소가 근접해있어 (MOE 2014), 자연적인 습지 식생을 보전하기 위해서는 외래식물의 유입을 막을 수 있는 방안이 고려되어야 할 것이다.
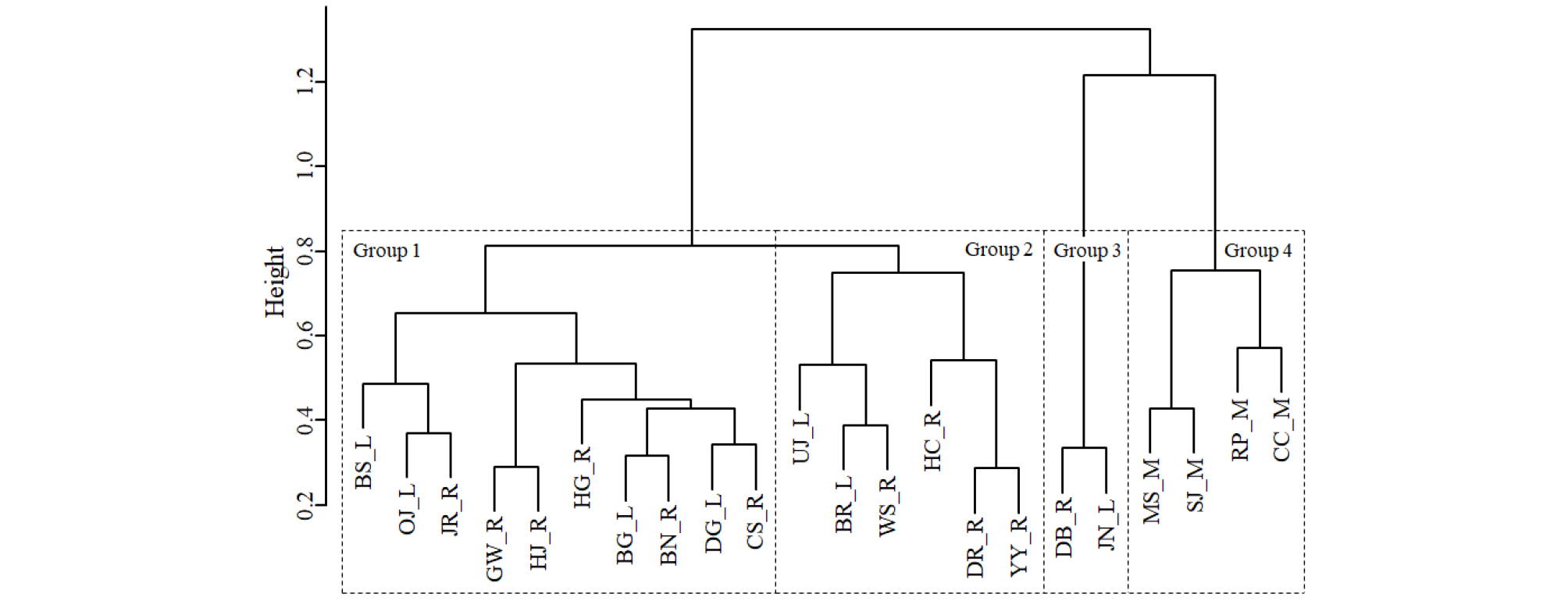
Fig. 3.
Classification of ecologically oustanding wetlands according to the alien flora. Box symbols represent four groups differentiated by a height level of 0.82. Codes: the first two characters, site name in Table 1; the next one characters L lacustrine, R riverine, M mountainous palustrine.
생태우수습지 유형별 외래식물 군집 특성을 비교하기 위하여 비모수다차원척도법 (NMDS)을 수행하였다 (stress value 0.1492, Fig. 4). 산지형 습지가 하천과 호수형 습지와 뚜렷하게 구분되는 것을 확인하였다 (Fig. 4 (a)). 1축의 우측 아래로 산지형 습지가 배열되었으며, 중심부에 호수형과 하천형습지가 밀집하여 배열되었다. 질날늪 (JN)과 대봉습지 (DB)의 경우 1축의 좌측 아래쪽으로 치우쳐 배열되어 있는데, 다른 하천 및 호수형 습지에 비해 외래종수가 10종 내외로 현저히 적으며 돌소리쟁이 (Ru.ob), 울산도깨비바늘 (Bi.pi) 등 특정종의 영향을 받은 것으로 판단된다. 미국가막사리 (Bi.fr), 미국자리공 (Ph.am), 서양민들레 (Ta.of), 소리쟁이 (Ru.cr), 족제비싸리 (Am.fr), 토끼풀 (Tr.re), 망초 (Co.ca), 아까시나무 (Ro.ps), 달맞이꽃 (Oe.od), 개망초 (Er.an) 등 10종은 중앙에 밀집하여 배열되어 있으며, 조사지점 대상 약 70% 이상의 생태우수습지에서 발견되었다 (Fig. 4 (b)). 이들 종은 우리나라에서 가장 흔하게 발견되는 외래식물로, 생태적으로 우수한 습지임에도 불구하고 대부분 분포하고 있는 것으로 나타났다. 또한 간월호 (GW), 도리섬 (DR), 비내섬 (BN), 합강습지 (HG), 침실습지 (CS), 황정습지 (HJ)에서 미국쑥부쟁이 (As.pi), 단풍잎돼지풀 (Am.tr), 돼지풀 (Am.ar), 가시박 (Si.an) 등 4종 이상의 생태계교란생물이 발견되어, 하천형 습지가 생태계교란생물의 침입에도 취약한 것으로 판단된다. 이는 하천 정비, 친수시설 이용 등 접근의 용이성이 높아 발생하는 교란과 식물 유입에 상대적으로 용이한 선형 통로로 역할을 수행하기 때문인 것으로 판단된다 (Richardson et al. 2007).
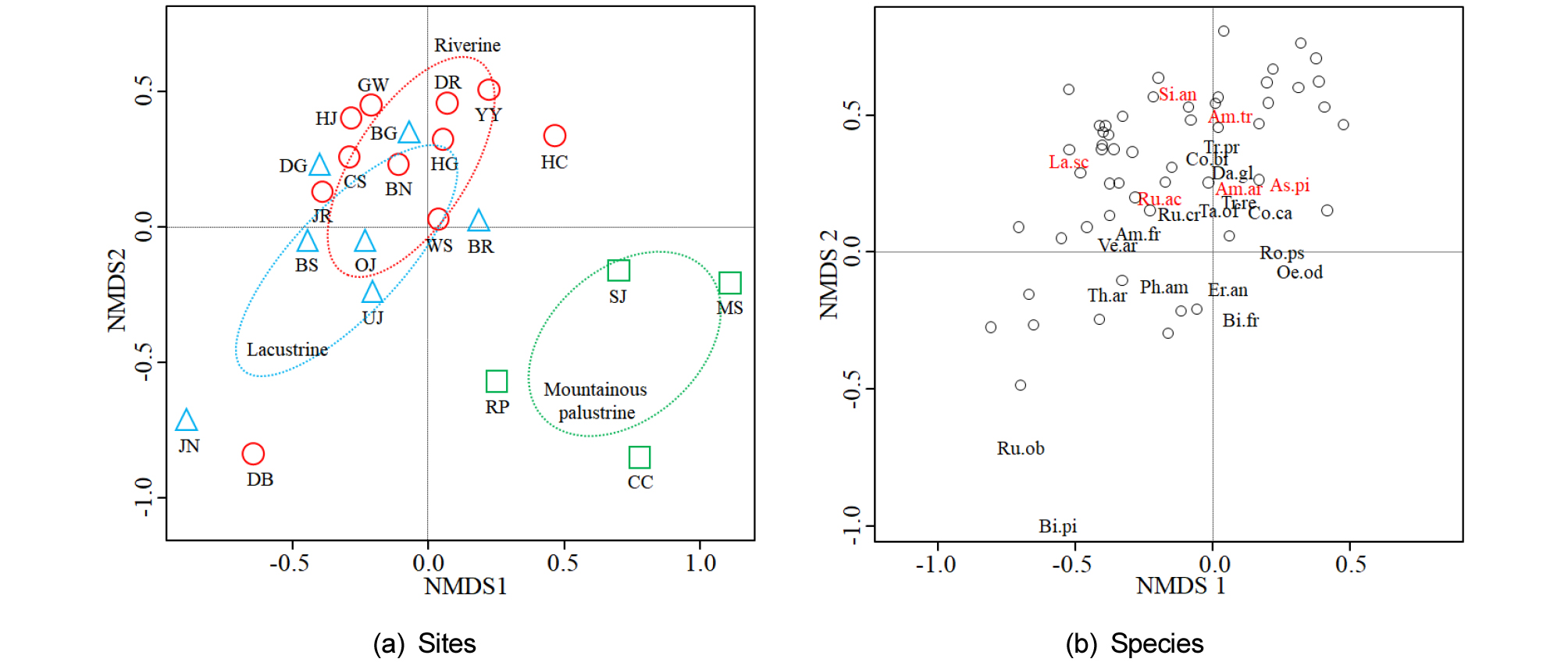
Fig. 4.
Biplots of nonmetric multidimensional scaling (NMDS) using alien flora data in the wetlands. (a) Wetland sites by habitat type (circle, riverine; triangle, lacustrine; square, mountainous palustrine; abbreviation in Table 1). All ellipse illustrate 95% confidence intervlas. (b) Distribution of alien plants (red text indicates invasive alien plant species designated by the Ministry of Environment, South Korea) (Am.ar, Ambrosia artemisiifolia var. elatior; Am.fr, Amorpha fruticosa; Am.tr, Ambrosia trifida; As.pi, Aster pilosus; Bi.fr, Bidens frondosa; Bi.pi, Bidens pilosa; Co.bi, Cosmos bipinnatus; Co.ca, Conyza canadensis; Da.gl, Dactylis glomerata; Er.an; Erigeron annuus; La.sc, Lactuca scariola; Oe.od, Oenothera odorata; Ph.am, Phytolacca americana; Ro.ps, Robinia pseudoacacia; Ru.ac, Rumex acetosella; Ru.cr, Rumex crispus; Ru.ob, Rumex obtusifolius; Si.an, Sicyos angulatus; Ta.of, Taraxacum officinale; Th.ar, Thlaspi arvense; Tr.pr, Trifolium pratense; Tr.re, Trifolium repens; Ve.ar, Veronica arvensis).
4. 결론 및 제언
본 연구 결과에 의하면, 총 22개의 생태우수습지에서 27과 60속 130종의 외래식물이 출현하였다. 이 중 국화과가 가장 많이 출현하였으며, 출현빈도가 가장 높은 외래식물은 개망초와 달맞이꽃이었다. 습지 유형별로는 하천형과 호수형 습지에서 산지형 습지보다 외래식물 종풍부도, 도시화지수, 귀화율 그리고 일‧이년생 비율이 높은 것으로 나타났다. 이는 자연적으로 발생하는 교란뿐만 아니라 정비사업, 도로를 통한 종자의 유입 및 확산, 관광객들의 접근 등 인위적인 교란도 지속해서 발생하기 때문에, 하천형 및 호수형 습지가 외래식물의 침입에 취약한 것으로 판단된다 (Bunn and Arthington 2002, Airoldi et al. 2005). 또한 하천형 습지에서 제방사면을 따라 생태계교란생물이 집중적으로 발견되어 체계적인 관리가 필요한 실정이다. 하천 제방은 일반적으로 주기적인 벌초 등 지속적인 관리가 이루어지기 때문에 외래식물 유입이 용이한 것으로 판단된다 (DeFerrari and Naiman 1994). 하천 제방에 접근하는 이용객과 수류 등에 의해 생태계교란생물 종자가 확산될 가능성이 높기 때문에 지방자치단체에서 적극적인 제거 작업 수행이 필요하다.
산지습지의 경우 개망초, 달맞이꽃, 아까시나무, 토끼풀 등 전국적으로 퍼져있는 귀화식물은 출현하나, 자연적인 장벽에 의해 상당수의 외래식물 침입이 방지됨으로써 생태계가 안정적으로 유지되고 있는 것으로 파악되었다. 특히 물찻오름과 숨은물뱅듸에서 외래식물이 발견되지 않은 점은 상당히 건강한 생태계가 유지되고 있음을 반증하는 것이며, 이를 보전할 수 있도록 교란을 최소화하여야 할 것이다.
멸종위기야생생물이 서식하고 생물다양성이 높아 생태적으로 우수한 습지임에도 불구하고 다양한 교란 요소에 의해 외래식물 침입에 취약한 것으로 파악되었다. 특히 이러한 외래식물의 침입은 하천형과 호수형 습지에서 취약하며 사람에 의한 인위적인 교란이 주된 원인으로 파악된다. 하지만 이러한 행위를 제재하고 보호할만한 법적 구속력은 부족하기 때문에 관계기관에서 우수습지 목록을 마련하고 주기적으로 모니터링 하여 외래식물 확산 방지를 위한 대책을 마련해야 할 것이다. 생태우수습지를 대상으로 외래식물 분포의 기초 현황 자료를 수집하고 유형별 분포 특성을 파악한 것은 향후 습지 보전 및 관리계획 수립 시 기초자료로 사용될 수 있을 것으로 기대된다.
Appendix 1.
List of alien plants in the ecologically outstading wetlands (abbreviation in Table 1)
|
Speceis
|
Family
|
Life cycle
|
BG
|
BR
|
BS
|
DG
|
JN
|
OJ
|
UJ
|
BN
|
CS
|
DB
|
DR
|
| Abutilon avicennae |
Malvaceae
|
Annual
| |
○
| | | | | | |
○
| |
○
|
| Ailanthus altissima |
Simaroubaceae
|
Perennial
| | | | | | | |
○
|
○
| | |
| Alopecurus pratensis |
Poaceae
|
Perennial
| | | |
○
| | | | | | | |
| Amaranthus lividus |
Amaranthaceae
|
Annual
| | | |
○
| | | |
○
| | | |
| Amaranthus patulus |
Amaranthaceae
|
Annual
| | | | | | | | |
○
| | |
| Amaranthus retroflexus |
Amaranthaceae
|
Annual
| | | | | | | | | | | |
| Amaranthus spinosus |
Amaranthaceae
|
Annual
| | | | | | | | | | | |
| Amaranthus viridis |
Amaranthaceae
|
Annual
| | | | | | | | | | | |
| Ambrosia artemisiifolia var. elatior |
Asteraceae
|
Annual
|
○
| | |
○
| | | |
○
|
○
| |
○
|
| Ambrosia trifida |
Asteraceae
|
Annual
|
○
| | | | |
○
| |
○
| | |
○
|
| Amorpha fruticosa |
Fabaceae
|
Perennial
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
| |
○
|
| Anthriscus caucalis |
Asteraceae
|
Annual
|
○
| | | | | | | |
○
| | |
| Anthemis cotula |
Apiaceae
|
Annual
| | | | | | | | | | | |
| Aster pilosus |
Asteraceae
|
Perennial
|
○
| |
○
| | | | |
○
|
○
| |
○
|
| Aster subulatus |
Asteraceae
|
Annual
| |
○
| |
○
| | |
○
| | | | |
| Aster subulatus var. sandwicensis |
Asteraceae
|
Annual
| | | | | | | | |
○
| | |
| Astragalus sinicus |
Fabaceae
|
Biennial
| | | |
○
|
○
|
○
|
○
| |
○
|
○
| |
| Avena fatua |
Poaceae
|
Biennial
| |
○
| | | | | | | | | |
| Barbarea vulgaris |
Brassicaceae
|
Perennial
|
○
| | | | | | | | | | |
| Bidens frondosa |
Asteraceae
|
Annual
|
○
| |
○
|
○
| | |
○
|
○
|
○
|
○
| |
| Bidens pilosa |
Asteraceae
|
Annual
| | | | |
○
| | | | |
○
| |
| Bilderdykia convolvulus |
Polygonaceae
|
Annual
| | | | | | | | | | | |
| Bilderdykia dentato-alata |
Polygonaceae
|
Annual
| | | | | | | |
○
| | | |
| Bilderdykia dumetora |
Polygonaceae
|
Annual
| | | | | | | | | | |
○
|
| Brassica juncea var. integrifolia |
Brassicaceae
|
Biennial
| | |
○
|
○
|
○
|
○
| | |
○
|
○
| |
| Bromus tectorum |
Poaceae
|
Biennial
| | | | | | | | | | |
○
|
| Carduus crispus |
Asteraceae
|
Biennial
|
○
| | | | | | |
○
| | |
○
|
| Centaurea cyanus |
Asteraceae
|
Biennial
| | | | | |
○
| | | | | |
| Cerastium glomeratum |
Caryophyllaceae
|
Biennial
|
○
|
○
| | | | | | | | | |
| Chenopodium album |
Chenopodiaceae
|
Annual
|
○
| | | | | | | |
○
| |
○
|
| Chenopodium ambrosioides |
Chenopodiaceae
|
Annual
| | | | | | | | | | | |
| Chenopodium ficifolium |
Chenopodiaceae
|
Annual
|
○
|
○
|
○
|
○
| | |
○
|
○
|
○
|
○
| |
| Chenopodium glaucum |
Chenopodiaceae
|
Annual
| | | |
○
| | |
○
| | | | |
| Chloris virgata |
Poaceae
|
Annual
| | | | | | | |
○
| | | |
| Conyza parva |
Asteraceae
|
Annual
| | | |
○
| | | | | | | |
| Conyza sumatrensis |
Asteraceae
|
Biennial
| | | |
○
| | |
○
| | | | |
| Coreopsis lanceolata |
Asteraceae
|
Perennial
| | | |
○
| |
○
| |
○
|
○
| |
○
|
| Coreopsis tinctoria |
Asteraceae
|
Annual
| | | | | |
○
|
○
| | | | |
| Cosmos bipinnatus |
Asteraceae
|
Annual
|
○
|
○
| | | |
○
| |
○
|
○
| |
○
|
| Cosmos sulphureus |
Asteraceae
|
Annual
| | | | | | |
○
| | | | |
| Crassocephalum crepidioides |
Asteraceae
|
Annual
| | | | | |
○
|
○
| |
○
| | |
| Cuscuta pentagona |
Convolvulaceae
|
Annual
|
○
| |
○
|
○
| | | |
○
|
○
| | |
| Dactylis glomerata |
Poaceae
|
Perennial
|
○
|
○
| |
○
| |
○
| |
○
|
○
| |
○
|
| Diodia teres |
Rubiaceae
|
Annual
| | | | | | | | |
○
| | |
| Eragrostis curvula |
Poaceae
|
Perennial
| | | | | | | | |
○
| | |
| Erechtites hieracifolia |
Asteraceae
|
Annual
|
○
| | |
○
| | |
○
|
○
|
○
| | |
| Erigeron annuus |
Asteraceae
|
Biennial
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
| Erigeron bonariensis |
Asteraceae
|
Biennial
| | | | | | | | | | | |
| Erigeron canadensis |
Asteraceae
|
Biennial
|
○
|
○
|
○
|
○
| |
○
|
○
|
○
|
○
| |
○
|
| Erigeron strigosus |
Asteraceae
|
Biennial
| | | | | | | | | | | |
| Euphorbia maculata |
Euphorbiaceae
|
Annual
| |
○
| | | | | | | | | |
| Euphorbia supina |
Euphorbiaceae
|
Annual
| | | |
○
| | | | | | | |
| Festuca arundinacea |
Poaceae
|
Perennial
|
○
| | | | | |
○
|
○
| | |
○
|
| Festuca heterophylla |
Poaceae
|
Perennial
|
○
| | | | | | | | | | |
| Festuca myuros |
Poaceae
|
Annual
| | | | | | | | |
○
| | |
| Galinsoga ciliata |
Asteraceae
|
Annual
|
○
| | | | | | | | | | |
| Galinsoga parviflora |
Asteraceae
|
Annual
| | | | | | | | | | | |
| Geranium carolinianum |
Geraniaceae
|
Annual
| | | | | | | | | | | |
| Helianthus tuberosus |
Asteraceae
|
Perennial
| | | | | | | | | | | |
| Hypochaeris radicata |
Asteraceae
|
Perennial
|
○
| |
○
| | | | | | | | |
| Indigofera bungeana |
Fabaceae
|
Perennial
|
○
| | | | | | | |
○
| |
○
|
| Ipomoea hederacea |
Convolvulaceae
|
Annual
| | | |
○
| | | |
○
|
○
| | |
| Ipomoea hederacea var. integriuscula |
Convolvulaceae
|
Annual
| | |
○
|
○
| | | | |
○
| | |
| Ipomoea lacunosa |
Convolvulaceae
|
Annual
| |
○
| |
○
| | | | |
○
| | |
| Ipomoea purpurata |
Convolvulaceae
|
Annual
| | | |
○
| | | | | | | |
| Jacquemontia taminifolia |
Convolvulaceae
|
Annual
| | | | | | | | |
○
| | |
| Lactuca scariola |
Asteraceae
|
Biennial
| | |
○
|
○
| | | |
○
| | | |
| Lamium purpureum |
Lamiaceae
|
Biennial
| |
○
| |
○
| | | | |
○
| | |
| Lepidium apetalum. |
Brassicaceae
|
Biennial
| | | | | | |
○
|
○
|
○
| | |
| Lepidium ruderale |
Brassicaceae
|
Biennial
|
○
| | | | | | | | | | |
| Lepidium virginicum |
Brassicaceae
|
Biennial
| |
○
| | | |
○
|
○
| | |
○
|
○
|
| Lindernia dubia |
Scrophulariaceae
|
Annual
|
○
| | | | | | | | | | |
| Lolium multiflorum |
Poaceae
|
Biennial
| | | | | | |
○
| |
○
| | |
| Lolium perenne |
Poaceae
|
Perennial
|
○
|
○
| |
○
| | |
○
| |
○
| | |
| Lotus corniculatus |
Fabaceae
|
Perennial
|
○
| | | | | | | | | | |
| Medicago hispida |
Fabaceae
|
Annual
| | | | | | | | | | | |
| Medicago lupulina |
Fabaceae
|
Biennial
|
○
| | | | | | | | | | |
| Medicago sativa |
Fabaceae
|
Perennial
|
○
| | | | | | | | | | |
| Melilotus alba |
Fabaceae
|
Biennial
| | | | | | | |
○
| | |
○
|
| Melilotus suaveolens |
Fabaceae
|
Biennial
| |
○
| | | | | | | | |
○
|
| Neslia paniculata |
Brassicaceae
|
Biennial
| | | | | | | | | | | |
| Oenothera laciniata |
Onagraceae
|
Biennial
| | | | | | | | | | | |
| Oenothera lamarckiana |
Onagraceae
|
Biennial
| | | | | | | | | | | |
| Oenothera odorata |
Onagraceae
|
Biennial
|
○
|
○
|
○
|
○
| |
○
|
○
|
○
|
○
| |
○
|
| Panicum dichotomiflorum |
Poaceae
|
Annual
|
○
| |
○
|
○
| | | | |
○
| | |
| Papaver rhoeas |
Papaveraceae
|
Annual
| | | | | |
○
| | | | | |
| Paspalum distichum |
Poaceae
|
Perennial
| |
○
| |
○
| | | | | | | |
| Paspalum distichum var. indutum |
Poaceae
|
Perennial
| | | |
○
| | | | | | | |
| Persicaria cochinchinensis |
Polygonaceae
|
Annual
| | |
○
| | | |
○
| | | | |
| Phleum pratense |
Poaceae
|
Perennial
| | | | | | | | | | |
○
|
| Physalis wrightii |
Solanaceae
|
Annual
| | | | | | | | | | | |
| Phytolacca americana |
Phytolaccaceae
|
Perennial
|
○
|
○
|
○
|
○
| |
○
|
○
|
○
|
○
|
○
|
○
|
| Plantago aristata |
Plantaginaceae
|
Annual
| | | | | | | |
○
| | | |
| Plantago virginica |
Plantaginaceae
|
Biennial
| | | | | | |
○
| | | | |
| Poa pratensis |
Poaceae
|
Perennial
|
○
| | | | | | | | | |
○
|
| Potentilla amurensis |
Rosaceae
|
Biennial
| | | | | | | | | | | |
| Potentilla paradoxa |
Rosaceae
|
Biennial
| | | | | | | |
○
|
○
| |
○
|
| Quamoclit angulata |
Convolvulaceae
|
Annual
|
○
| |
○
|
○
| | | | |
○
| | |
| Robinia pseudo-acacia |
Fabaceae
|
Perennial
|
○
|
○
| |
○
| |
○
|
○
|
○
|
○
| |
○
|
| Rudbeckia bicolor |
Asteraceae
|
Perennial
| | |
○
| | | | | | | | |
| Rudbeckia laciniata var. hortensis |
Asteraceae
|
Perennial
|
○
| | | | | | | | | | |
| Rumex acetocella |
Polygonaceae
|
Perennial
| | | | | | |
○
| |
○
| |
○
|
| Rumex crispus |
Polygonaceae
|
Perennial
|
○
| |
○
|
○
| |
○
|
○
|
○
|
○
| |
○
|
| Rumex obtusifolius |
Polygonaceae
|
Perennial
| | | | |
○
|
○
| |
○
| |
○
| |
| Senecio vulgaris |
Asteraceae
|
Annual
| | | |
○
| | | | | | | |
| Sicyos angulatus |
Cucurbitaceae
|
Annual
| | | | | | | |
○
|
○
| |
○
|
| Silene armeria |
Caryophyllaceae
|
Annual
|
○
| | | | | | | | | |
○
|
| Solanum americanum |
Solanaceae
|
Annual
| | | |
○
| | | | | | | |
| Solanum carolinense |
Solanaceae
|
Perennial
| | | | | | | | | | | |
| Solidago altissima |
Asteraceae
|
Perennial
| | | |
○
| | | | | | | |
| Solidago serotina |
Asteraceae
|
Perennial
| | | | | | | | | | | |
| Sonchus asper |
Asteraceae
|
Annual
| | |
○
|
○
| |
○
|
○
| | | | |
| Sonchus oleraceus |
Asteraceae
|
Annual
|
○
| | |
○
| | | |
○
| | | |
| Symphytum officinale |
Boraginaceae
|
Perennial
| | | | | | | | | | | |
| Tagetes minuta |
Asteraceae
|
Annual
| | | | | | | | | | | |
| Taraxacum officinale |
Asteraceae
|
Perennial
|
○
| |
○
|
○
| |
○
| |
○
|
○
| |
○
|
| Thlaspi arvense |
Brassicaceae
|
Biennial
|
○
| | | |
○
|
○
|
○
|
○
|
○
|
○
|
○
|
| Tragopogon dubius |
Asteraceae
|
Biennial
| | | | | | | | | | | |
| Trifolium dubium. |
Fabaceae
|
Perennial
| | | | | | | | | | | |
| Trifolium hybridum |
Fabaceae
|
Perennial
|
○
| | | | | | | | | | |
| Trifolium pratense |
Fabaceae
|
Perennial
|
○
|
○
| |
○
| |
○
| |
○
| | | |
| Trifolium repens |
Fabaceae
|
Perennial
|
○
|
○
| |
○
| |
○
|
○
|
○
|
○
| |
○
|
| Valerianella locusta var. olitoria |
Valerianaceae
|
Annual
| | | |
○
| | | | | | | |
| Veronica arvensis |
Scrophulariaceae
|
Annual
|
○
|
○
|
○
|
○
|
○
|
○
| |
○
| | |
○
|
| Veronica persica |
Scrophulariaceae
|
Biennial
| | |
○
|
○
|
○
|
○
|
○
| |
○
| | |
| Vicia dasycarpa |
Fabaceae
|
Biennial
| | |
○
| | | | | |
○
| | |
| Vicia villosa |
Fabaceae
|
Biennial
|
○
| | |
○
| | | | | | |
○
|
| Xanthium canadense |
Asteraceae
|
Annual
|
○
| | |
○
| | | | |
○
| | |
| Xanthium italicum |
Asteraceae
|
Annual
|
○
| | | | | | | |
○
| | |
| Xanthium strumarium |
Asteraceae
|
Annual
|
○
| | | |
○
| | |
○
|
○
|
○
| |
|
Speceis
|
Family
|
Life cycle
|
GW
|
HG
|
HJ
|
HC
|
JR
|
WS
|
YY
|
CC
|
MS
|
RP
|
SJ
|
| Abutilon avicennae |
Malvaceae
|
Annual
|
○
| | | | | | | | | | |
| Ailanthus altissima |
Simaroubaceae
|
Perennial
|
○
|
○
|
○
|
○
| | | | | | | |
| Alopecurus pratensis |
Poaceae
|
Perennial
| | | | | | | | | | | |
| Amaranthus lividus |
Amaranthaceae
|
Annual
|
○
| | | | | | | | | | |
| Amaranthus patulus |
Amaranthaceae
|
Annual
| | | | | | | | | | | |
| Amaranthus retroflexus |
Amaranthaceae
|
Annual
| | |
○
| | | | | | | | |
| Amaranthus spinosus |
Amaranthaceae
|
Annual
| | | | | | | | | | | |
| Amaranthus viridis |
Amaranthaceae
|
Annual
| | | | | | | | | | | |
| Ambrosia artemisiifolia var. elatior |
Asteraceae
|
Annual
|
○
|
○
|
○
| |
○
|
○
|
○
| | |
○
|
○
|
| Ambrosia trifida |
Asteraceae
|
Annual
|
○
|
○
| | | | |
○
| | | | |
| Amorpha fruticosa |
Fabaceae
|
Perennial
|
○
| |
○
| |
○
|
○
|
○
| | | | |
| Anthriscus caucalis |
Asteraceae
|
Annual
| | | | |
○
| | | | | | |
| Anthemis cotula |
Apiaceae
|
Annual
| |
○
| | | | | | | | | |
| Aster pilosus |
Asteraceae
|
Perennial
|
○
|
○
|
○
|
○
|
○
| | | |
○
| |
○
|
| Aster subulatus |
Asteraceae
|
Annual
| | | | | |
○
| | | | | |
| Aster subulatus var. sandwicensis |
Asteraceae
|
Annual
|
○
|
○
| | | | | | | | | |
| Astragalus sinicus |
Fabaceae
|
Biennial
| |
○
| | |
○
| | | | | | |
| Avena fatua |
Poaceae
|
Biennial
|
○
| | | | | | | | | | |
| Barbarea vulgaris |
Brassicaceae
|
Perennial
| | | | | | | | | | | |
| Bidens frondosa |
Asteraceae
|
Annual
|
○
|
○
|
○
|
○
| |
○
| |
○
| |
○
|
○
|
| Bidens pilosa |
Asteraceae
|
Annual
| | |
○
| | |
○
| | | |
○
| |
| Bilderdykia convolvulus |
Polygonaceae
|
Annual
| | | | | | | | | |
○
| |
| Bilderdykia dentato-alata |
Polygonaceae
|
Annual
| | | | | | | | | | | |
| Bilderdykia dumetora |
Polygonaceae
|
Annual
|
○
| |
○
| | | |
○
| | | | |
| Brassica juncea var. integrifolia |
Brassicaceae
|
Biennial
|
○
| |
○
| |
○
| | | | | | |
| Bromus tectorum |
Poaceae
|
Biennial
| | | | | |
○
|
○
| | | | |
| Carduus crispus |
Asteraceae
|
Biennial
| | |
○
|
○
| | |
○
| | | |
○
|
| Centaurea cyanus |
Asteraceae
|
Biennial
|
○
| |
○
| | | | | | | | |
| Cerastium glomeratum |
Caryophyllaceae
|
Biennial
|
○
|
○
| | | |
○
| | | | |
○
|
| Chenopodium album |
Chenopodiaceae
|
Annual
|
○
| | |
○
| | |
○
| | | | |
| Chenopodium ambrosioides |
Chenopodiaceae
|
Annual
| |
○
| | |
○
| | | | | | |
| Chenopodium ficifolium |
Chenopodiaceae
|
Annual
| | | | | | | | | | | |
| Chenopodium glaucum |
Chenopodiaceae
|
Annual
|
○
| | | | | | | | | | |
| Chloris virgata |
Poaceae
|
Annual
| | | | | | | | | | | |
| Conyza parva |
Asteraceae
|
Annual
| | | | | | | | | | | |
| Conyza sumatrensis |
Asteraceae
|
Biennial
| | | | | | | | | | | |
| Coreopsis lanceolata |
Asteraceae
|
Perennial
|
○
| |
○
| |
○
| | | | | | |
| Coreopsis tinctoria |
Asteraceae
|
Annual
| | |
○
| |
○
|
○
| | | | | |
| Cosmos bipinnatus |
Asteraceae
|
Annual
|
○
| |
○
|
○
|
○
|
○
| | | | | |
| Cosmos sulphureus |
Asteraceae
|
Annual
|
○
| | | | | | | | | | |
| Crassocephalum crepidioides |
Asteraceae
|
Annual
|
○
| | | | | | | | |
○
| |
| Cuscuta pentagona |
Convolvulaceae
|
Annual
|
○
| |
○
| |
○
| | | | | | |
| Dactylis glomerata |
Poaceae
|
Perennial
|
○
|
○
| |
○
| |
○
| | | | | |
| Diodia teres |
Rubiaceae
|
Annual
| | | | | | | | | | | |
| Eragrostis curvula |
Poaceae
|
Perennial
| | | | | | | | | | | |
| Erechtites hieracifolia |
Asteraceae
|
Annual
|
○
| | | | | | | | | | |
| Erigeron annuus |
Asteraceae
|
Biennial
|
○
|
○
|
○
|
○
|
○
|
○
|
○
| |
○
|
○
|
○
|
| Erigeron bonariensis |
Asteraceae
|
Biennial
|
○
|
○
| |
○
| | | | | | | |
| Erigeron canadensis |
Asteraceae
|
Biennial
|
○
|
○
|
○
|
○
|
○
|
○
|
○
| |
○
| |
○
|
| Erigeron strigosus |
Euphorbiaceae
|
Annual
| | | | | | | | | | |
○
|
| Euphorbia maculata |
Euphorbiaceae
|
Annual
|
○
| |
○
| | |
○
| | | | | |
| Euphorbia supina |
Euphorbiaceae
|
Annual
| | |
○
| | | |
○
| | | | |
| Festuca arundinacea |
Poaceae
|
Perennial
| | | | | |
○
|
○
| | | | |
| Festuca heterophylla |
Poaceae
|
Perennial
| | | | | | | | | | | |
| Festuca myuros |
Poaceae
|
Annual
| | | | | | | | | | | |
| Galinsoga ciliata |
Asteraceae
|
Annual
|
○
| | |
○
| | |
○
| | | | |
| Galinsoga parviflora |
Asteraceae
|
Annual
| | | | | | | | | | | |
| Geranium carolinianum |
Geraniaceae
|
Annual
| | | | |
○
| | | | | | |
| Helianthus tuberosus |
Asteraceae
|
Perennial
|
○
| |
○
|
○
| |
○
| | | | | |
| Hypochaeris radicata |
Asteraceae
|
Perennial
| | | | | | | | | | | |
| Indigofera bungeana |
Fabaceae
|
Perennial
| |
○
| | | | | | | | | |
| Ipomoea hederacea |
Convolvulaceae
|
Annual
|
○
|
○
|
○
| |
○
| | | | | | |
| Ipomoea hederacea var. integriuscula |
Convolvulaceae
|
Annual
| | | | |
○
| | | | | | |
| Ipomoea lacunosa |
Convolvulaceae
|
Annual
| | |
○
| |
○
| | | | | | |
| Ipomoea purpurata |
Convolvulaceae
|
Annual
| | |
○
| |
○
| |
○
| | | | |
| Jacquemontia taminifolia |
Convolvulaceae
|
Annual
| | | | | | | | | | | |
| Lactuca scariola |
Asteraceae
|
Biennial
|
○
| |
○
| | | | | | | | |
| Lamium purpureum |
Lamiaceae
|
Biennial
| | | | | | | | | | | |
| Lepidium apetalum |
Brassicaceae
|
Biennial
|
○
|
○
|
○
| | |
○
| | | | | |
| Lepidium ruderale |
Brassicaceae
|
Biennial
| | | | | | | | | | | |
| Lepidium virginicum |
Brassicaceae
|
Biennial
| | | | |
○
|
○
|
○
| | | | |
| Lindernia dubia |
Scrophulariaceae
|
Annual
| |
○
| | | | | | | | | |
| Lolium multiflorum |
Poaceae
|
Biennial
|
○
| | | | | | | | | | |
| Lolium perenne |
Poaceae
|
Perennial
|
○
| | | | | | | | | |
○
|
| Lotus corniculatus |
Fabaceae
|
Perennial
| | |
○
| |
○
| | | | | | |
| Medicago hispida |
Fabaceae
|
Annual
| | | | | | | | | | | |
| Medicago lupulina |
Fabaceae
|
Biennial
| | | | | | | | | | | |
| Medicago sativa |
Fabaceae
|
Perennial
| | |
○
| |
○
| | | | | | |
| Melilotus alba |
Fabaceae
|
Biennial
| | | | | | | | | | | |
| Melilotus suaveolens |
Fabaceae
|
Biennial
|
○
|
○
|
○
|
○
| | |
○
| | | | |
| Neslia paniculata |
Brassicaceae
|
Biennial
| | | | | | | | | | | |
| Oenothera laciniata |
Onagraceae
|
Biennial
| | | | | | | | | | | |
| Oenothera lamarckiana |
Onagraceae
|
Biennial
| | | | | | | | | | | |
| Oenothera odorata |
Onagraceae
|
Biennial
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
| Panicum dichotomiflorum |
Poaceae
|
Annual
| |
○
| | | |
○
| | | | | |
| Papaver rhoeas |
Papaveraceae
|
Annual
|
○
| |
○
| | | | | | | | |
| Paspalum distichum |
Poaceae
|
Perennial
| | | | | | | | | | | |
| Paspalum distichum var. indutum |
Poaceae
|
Perennial
| | | | | | | | | | | |
| Persicaria cochinchinensis |
Polygonaceae
|
Annual
| | | | | | | | | | | |
| Phleum pratense |
Poaceae
|
Perennial
| | | |
○
| | | | | | | |
| Physalis wrightii |
Solanaceae
|
Annual
| |
○
| | | | | | | | | |
| Phytolacca americana |
Phytolaccaceae
|
Perennial
|
○
|
○
| | |
○
|
○
| | | |
○
| |
| Plantago aristata |
Plantaginaceae
|
Annual
| | | | | | | | | | | |
| Plantago virginica |
Plantaginaceae
|
Biennial
| | | | | | | | | | | |
| Poa pratensis |
Poaceae
|
Perennial
| | | | | | |
○
| | | | |
| Potentilla amurensis |
Rosaceae
|
Biennial
| | |
○
| | | | | | | | |
| Potentilla paradoxa |
Rosaceae
|
Biennial
| |
○
|
○
| |
○
| |
○
| | | | |
| Quamoclit angulata |
Convolvulaceae
|
Annual
|
○
| |
○
| |
○
| | | | | | |
| Robinia pseudo-acacia |
Fabaceae
|
Perennial
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
| |
○
|
○
|
| Rudbeckia bicolor |
Asteraceae
|
Perennial
| | | | | | | | | | | |
| Rudbeckia laciniata var. hortensis |
Asteraceae
|
Perennial
| | | | | | | | | | | |
| Rumex acetocella |
Polygonaceae
|
Perennial
| |
○
| | |
○
| | | | | | |
| Rumex crispus |
Polygonaceae
|
Perennial
|
○
|
○
|
○
| |
○
|
○
|
○
| | |
○
| |
| Rumex obtusifolius |
Polygonaceae
|
Perennial
| |
○
| | | | | | | | | |
| Senecio vulgaris |
Asteraceae
|
Annual
|
○
| |
○
| | | | | | | | |
| Sicyos angulatus |
Cucurbitaceae
|
Annual
|
○
|
○
|
○
| | | | | | | | |
| Silene armeria |
Caryophyllaceae
|
Annual
| |
○
| | | | | | | | | |
| Solanum americanum |
Solanaceae
|
Annual
| | | | | | | | | | | |
| Solanum carolinense |
Solanaceae
|
Perennial
| | | | |
○
|
○
| | | | | |
| Solidago altissima |
Asteraceae
|
Perennial
| | | | | | | | | | | |
| Solidago serotina |
Asteraceae
|
Perennial
| | | | |
○
| | | | | | |
| Sonchus asper |
Asteraceae
|
Annual
|
○
| |
○
| |
○
| | | | | | |
| Sonchus oleraceus |
Asteraceae
|
Annual
| | | | | | | | | | | |
| Symphytum officinale |
Boraginaceae
|
Perennial
| | | | | | | | |
○
| | |
| Tagetes minuta |
Asteraceae
|
Annual
|
○
| |
○
| | | | | | | | |
| Taraxacum officinale |
Asteraceae
|
Perennial
|
○
|
○
|
○
|
○
|
○
|
○
|
○
|
○
| | | |
| Thlaspi arvense |
Brassicaceae
|
Biennial
| | |
○
| | | |
○
| | | | |
| Tragopogon dubius |
Asteraceae
|
Biennial
| | |
○
| | | | | | | | |
| Trifolium dubium. |
Fabaceae
|
Perennial
| | | | |
○
| | | | | | |
| Trifolium hybridum |
Fabaceae
|
Perennial
| | | | | | | | | | | |
| Trifolium pratense |
Fabaceae
|
Perennial
|
○
|
○
|
○
|
○
|
○
|
○
|
○
| | | | |
| Trifolium repens |
Fabaceae
|
Perennial
|
○
|
○
|
○
|
○
| |
○
|
○
| | |
○
| |
| Valerianella locusta var. olitoria |
Valerianaceae
|
Annual
| | | | |
○
| | | | | | |
| Veronica arvensis |
Scrophulariaceae
|
Annual
|
○
| |
○
| |
○
|
○
| | | | | |
| Veronica persica |
Scrophulariaceae
|
Biennial
| |
○
| | |
○
| | | | | | |
| Vicia dasycarpa |
Fabaceae
|
Biennial
| | | | | | | | | | | |
| Vicia villosa |
Fabaceae
|
Biennial
| |
○
| |
○
| | | | | | | |
| Xanthium canadense |
Asteraceae
|
Annual
| |
○
| | | |
○
| | | | | |
| Xanthium italicum |
Asteraceae
|
Annual
| | | | | | | | | | | |
| Xanthium strumarium |
Asteraceae
|
Annual
|
○
| |
○
| |
○
| | | | | | |








